近期,第七届中国生物医药创新合作大会在广州知识城会展中心盛大开幕。大会聚焦于细胞与基因治疗(CGT)产业发展,汇聚权威领袖、行业专家以及投资项目负责人等重磅大咖,以1场全体大会、9场专题论坛的形式展开为期两日的行业讨论。

第七届中国生物医药创新合作大会现场
高腾生物CGT总经理韦庆焜在本次大会上作主题为“细胞基因治疗产品的产业化解决方案”的精彩演讲,为观众展示了高腾生物CGT CDMO的服务范围与硬核实力。

高腾生物总经理韦庆焜演讲
据公开数据显示,全球CGT大多数处于早期研发阶段(包括临床前研究和临床Ⅰ期),CGT市场处于萌芽期。我国开展的CGT临床试验数量目前位居全球第二,临床开发热情高涨。为进一步拓展这个领域,国家从十三五到十四五期间出台了很多政策与CGT相关的治疗原则,旨在加快产业发展。
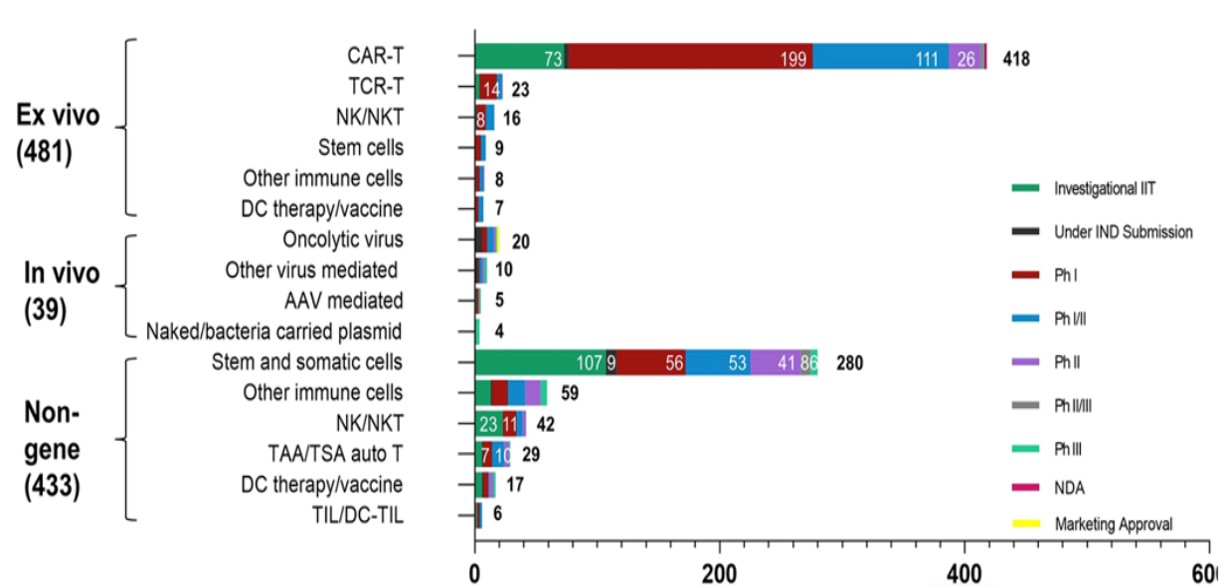
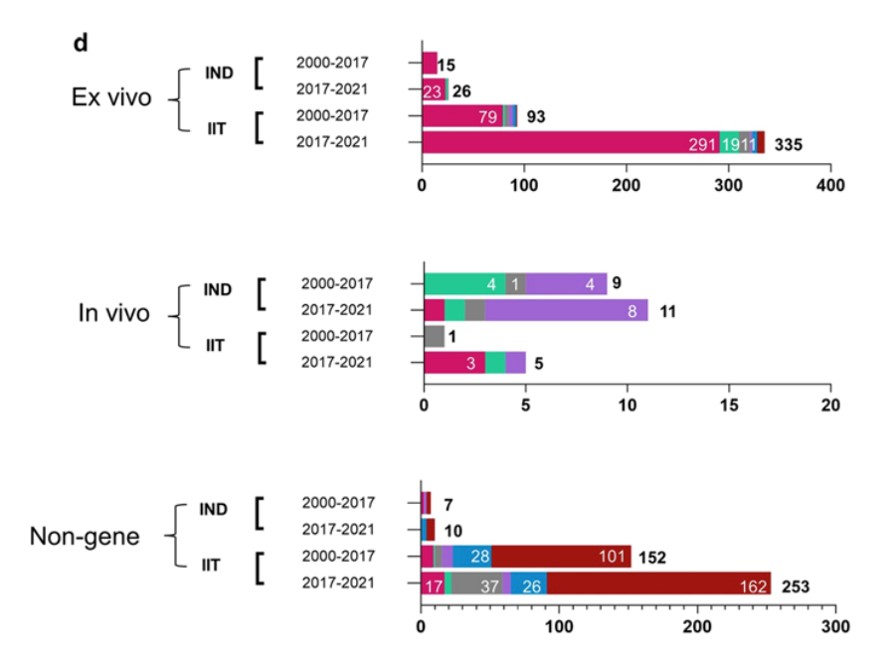
CGT全球研发现状
Yin et al. Journal of Hematology & Oncology (2022) 15:139
由于复杂的技术机制、高门槛的工艺开发和大规模生产、严苛的法规监管要求、有限的产业化经验,使得CGT产品相比传统制药更加依赖CDMO。高腾生物顺应产业发展规律,依托开云线上(中国)官方网站已成熟的大分子CDMO服务平台,致力打造国际化一站式CGT CDMO平台,专注于提供蛋白、质粒、慢病毒、腺病毒、AAV、免疫细胞、干细胞等生产服务,包括工艺和分析方法开发和验证、方法学转移、小试、中试、GMP/商业化生产、IND注册申报等一站式专业化服务, 竭诚为客户提供生物类药物药理/毒理批、临床试验用药及上市后商业化生产。
谈及高腾生物CGT CDMO的服务能力,韦庆焜指出,对于生物制药产业化的技术平台,无论抗体药物还是CGT药物,底层的产业化逻辑体系都是类似的,一个药物靶标到一个成熟的商业化产品都需要经过递送体系、宿主细胞选择、上游放大方案、下游纯化工艺、制剂方法以及贯穿全过程的质量控制等层层挑战,这也是高腾生物CGT产业化的解决思路。
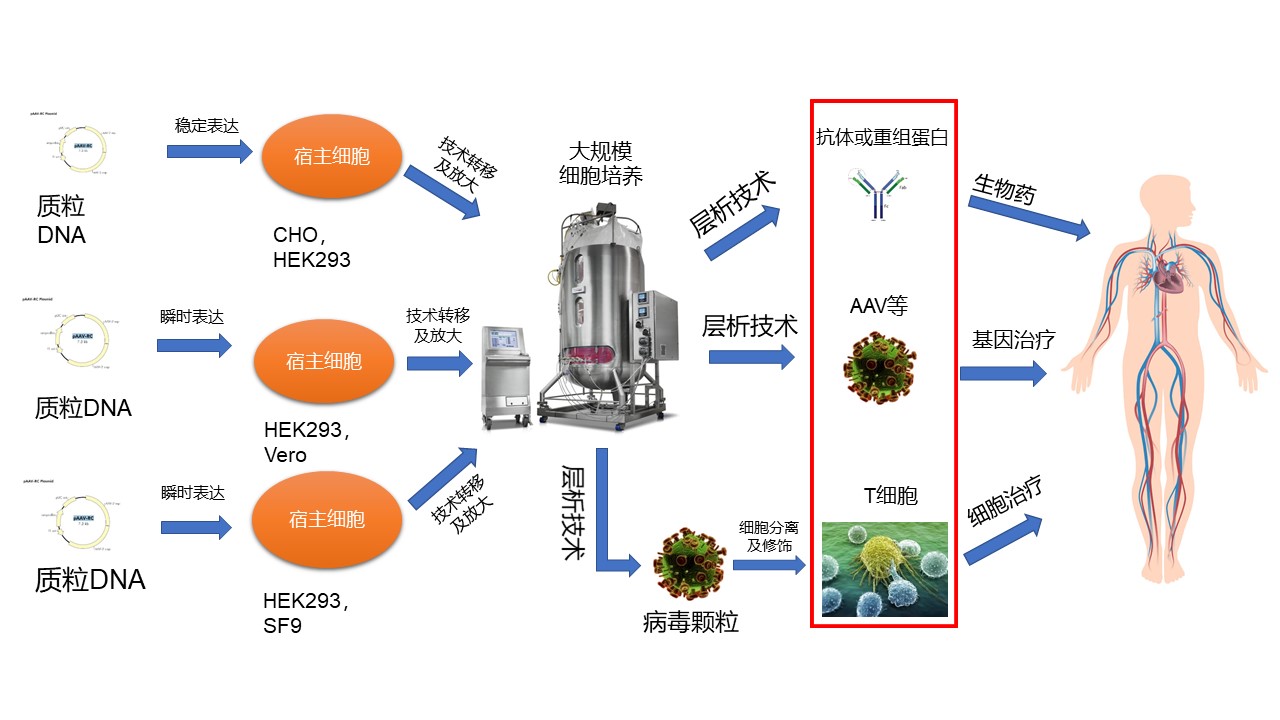
一、药物递送体系
病毒载体生产壁垒高、步骤复杂。高腾生物的CGT药物递送体系有多个选择,包括腺病毒(Adv)以及腺相关病毒(AAV)、慢病毒(LV)和溶瘤病毒(HSV)。韦庆焜指出,这些病毒载体各有优势,比如LV,主要用于T细胞的修饰;AAV适用性更广泛,理化更稳定,免疫原性低,研究更透彻;HSV对于肿瘤细胞的特异性有更大的优势。至于选择哪一种病毒载体,可从药物性质、给药方式以及成本等方面考虑。
二、宿主细胞选择
不同病毒载体导致可选的宿主细胞是有差异的,常用的宿主细胞体系包括了CHO细胞、Vero细胞和GEX细胞等。韦庆焜强调,高腾生物CHO细胞株已获得商业化授权许可,优势是高产能力(最高可达20g/L的目标产物表达量),表现出持续良好的生长表型,容易适应各种化学成分限定的培养基,以及能够进行人类兼容的糖基化等诸多特点,适合大规模工业化培养。
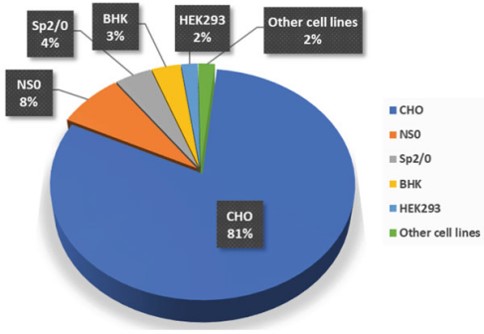
CHO细胞是最常用的宿主细胞,从1987 年到2021年2月,通过培养的哺乳动物细胞生产的获批生物药中有 81% 是使用CHO细胞生产。
而Vero细胞因β和α基因缺陷不能表达干扰素蛋白,对病毒易感,适用于各种灭活病毒疫苗的生产,并已拥有商用的HEK293细胞株。另外,GLYCOEXPRESS® (GEX®)细胞是由德国Glycotope公司与开云线上(中国)官方网站联合开发的源自人类髓性白血病细胞系,其优势在于灌流培养中表现出优异的生长能力(5*107cell/mg),并且在工艺转移技术中,我们已完成10L-1000L规模的稳定性测试,几乎没有表现差异。
三、上游工艺放大
上游工艺平台的选择策略,需要从技术层面(递送系统、宿主细胞类型等)以及非技术层面(项目阶段、目的以及法规、商业价值等)考虑。以病毒载体为例,除固定床反应器/细胞工厂以及搅拌式细胞培养以外,高腾生物的放大工艺亮点在于环轨式悬浮细胞培养技术,最大体积培养可高达2500L,可减少搅拌式培养带来的剪切力,适应范围广。
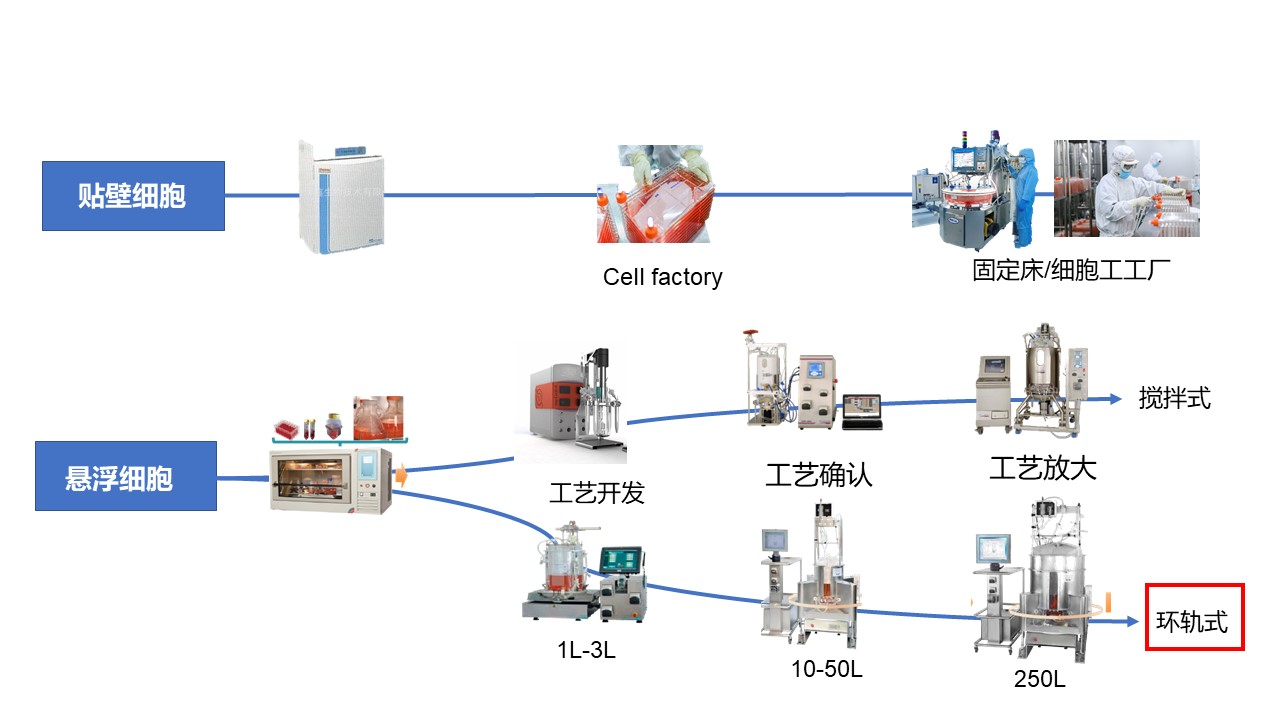
环轨式细胞培养的工艺放大难点中等,运营成本相比较低。
四、下游工艺纯化
超速离心虽具备纯度高、滴度高和工艺简单等优势,但难以实现大规模生产。韦庆焜提出,商业化生产需要标准化、规模化和流程化,高腾生物的下游工艺纯化平台主要通过澄清、超滤和纯化等步骤来实现,还可以把控无菌、工艺稳定性等指标。
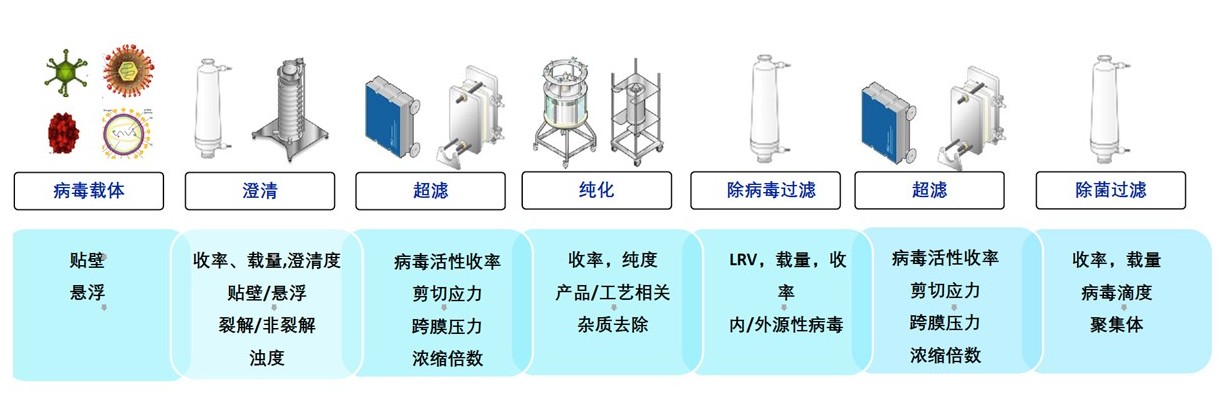
标准的病毒载体下游工艺平台建立
五、制剂方案开发
考虑给药方式,那就要建立制剂处方和工艺开发平台。通常在选定制剂方案和包材之后,还需要考虑可开发性研究,处方和工艺开发,对制剂的稳定性进行考察。除液体、冻干等制剂形式外,鼻喷制剂成为基因治疗/蛋白产品的一种新给药方式,高腾生物具备完整的鼻喷制剂方案开发能力。

高腾生物可进行液体、冻干、鼻喷/吸入式制剂方案开发
六、质量体系控制
质量控制是CGT研发过程中最复杂的事。高腾生物已建立研发阶段和符合GMP生产阶段的质量管理体系和管理流程,持续维持法规要求,符合CGT项目申报或商业化上市审查。研发及生产过程中,我们不仅需要对质粒、病毒载体和细胞等方面进行质控,还需要保证实验数据的完整性、真实性和可追溯性。
面对层层挑战,高腾生物专注技术创新,攻坚生产“卡脖子”问题。韦庆焜表示,在国家政策支持以及投融资环境良好的背景下,高腾生物以成为粤港澳大湾区CGT CDMO龙头企业,业务辐射至亚洲、欧洲等海外市场为目标,致力于为国内外CGT公司提供从研发到商业化生产的一站式CDMO服务。
关于高腾生物:
高腾生物是一家专注于打造领先CGT CDMO 服务平台的企业,由开云线上(中国)官方网站与广州高新区投资集团有限公司协同合作开发,核心团队由具有专业科研和管理经验的优秀人才组成,业务覆盖蛋白、质粒、科研级/工业级病毒、免疫细胞、干细胞生产工艺和分析方法学开发及验证、中试生产、分析和质量控制、方法学转移、IND申报等。
目前有深圳光明区研发和工艺开发中心和广州黄埔区中试和生产中心两大基地。基地建设基于QbD理念设计,具备符合国际标准的cGMP生产设施,独立的GMP生产线,全封闭系统,有效防止批间交叉污染;另外,产能布局灵活,满足不同IND到BLA到商业化规模的生产。




